Tugas 3
Soal : Pilihan Ganda Dari Tugas Kelompok ( Chapter 4.4 - 4.8 )
B. 0,375 M D. 1 M
V = 200 mL
Ditanya : M ?
Penyelesaian soal :
Tahap 1 :
Sebelum dihitung molaritas CO(NH₂)₂, hitunglah terlebih dahulu massa molekul relatif (Mr) senyawa CO(NH₂)₂ yaitu sebagai berikut :
Mr CO(NH₂)₂ = Ar C + Ar O + (2 × Ar N) + (4 × Ar H)
= 12 + 16 + (2 × 14) + (4 × 1)
= 12 + 16 + 28 + 4
= 60 g/molTahap 2 :
Untuk menghitung konsentrasi/ molaritas CO(NH₂)₂ dengan menggunakan rumus berikut ini :
M =
Dimana :
M = molaritas suatu zat (mol/L)
g = massa suatu zat (gram)
Mr = massa molekul relatif suatu zat (gr/mol)
V = volume larutan (mL)Secara perhitungan berdasarkan soal maka :
M =
=
= 0,05 mol × 5 L⁻¹
= 0,25 mol/L
B. 12.5 ml D. 14 ml
V HCl encer = 100 mL
[HCl] pekat = 1 N
ditanya : V HCl pekat ?
Jawab :
Hitung volume yang diperlukan larutan induk dengan menggunakan cara :
V₁ × M₁ = V₂ × M₂
V₁ × 1 N = 100 mL × 0,1 N
V₁ × 1 N = 10 N.mL
V₁ = 10 N.mL / 1 N
V₁ = 10 mL
B. CH3COOH (Ka = 1,8 x 10-5)
C. HCl (Ka = 1 x 106 )
D. NH3 (Ka = 10-33)
B. -4 D. +4
Kuis : 2 Soal Pilihan Ganda per chapter Dari Chapter 1 - 12
( Kecuali Chapter kelompok )
A. unsur
B. senyawa
C. campuran
D. zat
A. hidrogen, nitrogen, dan oksigen
B. natrium, magnesium, dan alumunium
C. karbon, fosfor, dan kalium
D. nitrogen, silikon, dan raka
A. 21 C. 19 E. 17
B. 20 D. 18
2. Lambang suatu unsur ![]() dapat disimpulkan bahwa pada satu atom unsur X mempunyai. . .
dapat disimpulkan bahwa pada satu atom unsur X mempunyai. . .
A. 18 neutron dan 18 proton
B. 22 neutron dan 22 proton
C. 40 proton dan 18 elektron
D. 18 proton dan 22 neutron
E. 18 neutron, 22 proton, dan 22 elektron

N2(g) + 3H2(g) → 2NH3 (g)
Volume gas NH3 maksimum yang dihasilkan pada STP adalah ….
A. 0,112 liter
B. 0,224 liter
C. 0,448 liter
D. 0,1344 liter
E. 1,792 liter
Jawab :
N2 + 3H2 -> 2NH3
0,04 0,03 2/3X0,03= 0.02
yang ditanya volume NH3 pada stp
n NH3 =0,02 mol
V NH3(stp) = 0,02x22,4= 0,448 L
A. 8,31 Pa
B. 83,1 Pa
C. 831 Pa
D. 8310 Pa
E. 83100 Pa
B. 3,32 10-3 m3
C. 4,16 10-3 m3
D. 6,16 10-3 m3
E. 7,32 10-3 m3
Dengan menggunakan persamaan keadaan gas ideal
Diketahui:
p = 1,25×105 Pa = 5/4 x105 Pa
n = 7/28 mol
R = 8,31 j/mol K
T = 250K
Ditanya:
Volume gas nitrogen N2
A. Entalpi pereaksi bertambah
B. Entalpi peraksi berkurang
C. Entalpi pereaksi dan hasil reaksi bertambah
D.. Entalpi pereaksi lebih besar daripada entalpi hasil reaksi
E. Entalpi hasil reaksi lebih besar daripada entalpi pereaksi
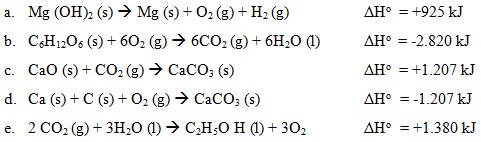
A. n = 2, l = 0, m = 0 , s = – ½
B. n = 3, l = 1, m = 0 , s = – ½
C. n = 3, l = 1, m = 0 , s = + ½
D. n = 3, l = 1, m = -1 , s = – ½
E. n = 3, l = 1, m = +1, s = + ½
Jawab :
elektron terakhir terletak di subkulit 3p⁵
n = 3 (didapat dari nomor kulit)
ℓ = 1 (didapat dari subkulit s)
m = 0 (didapat orbital yang ditempati elektron terakhir)
[↑↓ ][↑↓ ][↑ ]
-1 0 +1
s = -¹/₂ (didapat dari arah putaran elektron terakhir yaitu ↓)
Bilangan kuantum: n = 3, ℓ = 1, m = 0, s = -¹/₂
A. [Ar] 3d9 4s2
B. [Ar] 3d10 4s1
C. [Kr] 4d9 5s1
D. [Ar] 4d9 5s2
E. [Kr] 4d10 5s1
A. Periode 4, golongan IA, [Ar] 4s1
B. Periode 1, golongan IB, [Ar] 4d1
C. Periode 1, golongan IIA, [Ar] 4s2
D. Periode 2, golongan IIB, [Ar] 4d2
E. Periode 3, golongan IVA, [Ar] 4s2 3d2
2. Suatu unsur dapat membentuk senyawa ionik dengan rumus X2O3. Data energi ionisasi ke- 1 sampai ke-6 (dalam kJ/mol) untuk unsur X adalah .....
A. 500, 4.500, 6.910, 9.540, 13.350, 16.610B. 577, 1.816, 2.744, 11.576, 14.829, 18.375
C. 1.090, 2.350, 4.620, 6.220, 37.830, 47.280
D. 1.400, 2.860, 4.580, 7.480, 9.400, 53.270
E. 1.680, 3.370, 6.050, 8.410, 11,020, 15.160
Karena X stabil setelah melepaskan 3 elektron (ditandai dengan muatan 3+ saat membentuk senyawa) maka untuk melepaskan elektron keempat energi ionisasinya menjadi sangat besar, melonjak, naik drastis, dari energi ionisasi ketiga ke energi ionisasi keempat.
A. Elekcron valensi
B. Kecendrungan membentuk konfigurasi electron gas mulia
C. Lintasan electron
D.. Neutron dalam inti atom
E. Proton dan neutron
- P: 2 8 7
- Q: 2 8 8 1
- R: 2 8 18 2
- S: 2 8 8
- T: 2 8 18 4
Diantara unsur di atas, yang paling stabil (paling sukar membentuk ikatan kimia) adalah ….
A. P
B. Q
C. R
D. S
E. T
Gambar orbital di atas menunjukkan bahwa orbital yang terlibat adalah orbital s dan p, sehingga jenis hibridisasinya adalah hibridisasi sp.
A. Gaya antar molekul
B. Gaya tarik-menarik dipol-dipol
C. Gaya induksi
D. Gaya dispersi
E. Gaya London
A. HF
B. NH3
C. H2O
D. CH4
E. NaCl
A.. Jenis zat terlarut
B. Jenis zat pelaut
C. Jumlah zat pelarut
D. Jumlah zat terlarut
E. Konsentrasi larutan
A. 1,75 mol/kg
B. 1,87 mol/kg
C. 1,77 mol/kg
D. 1,85 mol/kg
E. 1,90 mol/kg
Basis perhitungan 1 L larutan fruktosa
Kemolalan laerutan fruktosa, m = n fruktosa / w air x 1.000
Diketahui, dalam 1 L larutan
– mol fruktosa, n Fruktosa = 1,476 mol
– menghitung massa air, w air = w larutan –w froktosa
Massa larutan
= ρ x V
= 1,1 g/Ml x 1000 ml
= 1100 g
Massa fruktosa = n fruktosa x Mm
= 1,476 mol x 180 g/mol
= 265,6 g
Diperoleh w air = w larutan – w fruktosa = 1100 g – 265,6 g = 834,4 g
Jadi, kemolalan larutan fruktosa
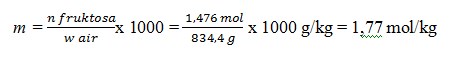



Tidak ada komentar:
Posting Komentar