Tugas 1
Contoh soal :
Solusi disiapkan dengan melarutkan 42.23g dari NH4Cl ke dalam air yang cukup untuk membuatnya 500.0mLsolusi. Hitung molaritasnya.
Larutan
Langkah 1: Buat daftar jumlah yang diketahui dan rencanakan masalahnya.
Diketahui
- Massa NH4Cl = 42,23g
- Massa molar dari NH4Cl = 53,50g / mol
- Volume larutan = 500.0mL = 0,5000L
Tidak diketahui
Molaritas = ?MMassa amonium klorida pertama-tama diubah menjadi mol. Kemudian, molaritas dihitung dengan membagi dengan liter. Perhatikan bahwa volume yang diberikan telah diubah menjadi liter.
42.23gNH4Cl ×1molNH4Cl53.50gNH4Cl= 0,7893molNH4Cl
0.7893molNH4Cl0,5000L= 1,579M
2. Berapa konsentrasi dari larutan asam asetat CH3COOH jika diketahui untuk titrasi 25 mL larutan CH3COOH tersebut diperlukan 15 mL larutan NaOH 0,05 M agar mencapai titik ekivalen?
Jawab:
Persamaan reaksi netralisasi CH3COOH dengan NaOH:
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
Dari persamaan reaksi, diperoleh: 1 mol CH3COOH 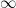 1 mol NaOH
1 mol NaOH
3. Sebanyak 40 mL larutan asam sulfat 0,25 M dititrasi dengan suatu basa bervalensi satu, dan ternyata dibutuhkan 57 mL basa tersebut. Berapakah kemolaran basa yang digunakan tersebut?
Jawab:
Reaksi netralisasi terjadi antara asam sulfat H2SO4 (asam kuat bervalensi dua) dengan suatu basa bervalensi satu.

Kuis :
1. (4.12) Prediksikan dan jelaskan sistem mana dari berikut ini yang menghantarkan listrik:
(a) NaCl padat,
(b) NaCl cair,
(c) larutan berair NaCl.
jawab :
(a) NaCl padat tidak bisa menghantarkan listrik, karena ion ionnya terperangkap dan tidak bisa
bergerak bebas. oleh karena itu NaCl padat tidak bisa menghantarkan listrik.
(b) NaCl Cair bisa menghantarkan listrik karena ion ion di dalamnya bergerak bebas dan bisa
mengnatrakan listrik.
(c) Larutan berair NaCl bisa menghantarkan listrik karena ion ion di dalamnya bergerak bebas dan bisa mengnatrakan listrik.
2. (4.21) Tuliskan persamaan ionik dan ionik bersih sebagai berikut
reaksi:
(a) AgNO3(aq) + Na2SO4(aq) --> NaNO3 + Ag2SO4
(b) BaCl2(aq) + ZnSO4(aq) --> BaSO4 + ZnCl2
(c) (NH4)2CO3(aq) + CaCl2(aq) --> CaCO + Cl3NH4
3. (4.52) Manakah dari logam berikut yang dapat bereaksi dengan air?
(a) Au, Tidak bisa
(b) Li, Mudah bereaksi dengan air membentuk gas hidrogen dan litium hidroksida
(c) Hg, Tidak Bisa
(d) Ca, Bereaksi dengan air melepaskan gas hidrogen
(e) Pt. Tidak Bisa
1 mol NaOH



Tidak ada komentar:
Posting Komentar