Latihan 5
Contoh soal :
1. Contoh 16.13
Manakah dari senyawa berikut yang akan lebih larut dalam larutan asam daripada dalam air: (a) CuS, (b) AgCl, (c) PbSO₄?
Strategi
Dalam setiap kasus, tuliskan reaksi disosiasi garam ke dalam kation dan anionnya. Kation tidak akan berinteraksi dengan ion H⁺ karena keduanya memiliki muatan positif. Anion akan bertindak sebagai akseptor proton hanya jika anion merupakan basa konjugasi dari asam lemah. Bagaimana penghilangan anion mempengaruhi kelarutan garam?
Penyelesaian
(a) Kesetimbangan kelarutan untuk CuS adalah
CuS(s) ⇋ Cu²⁺(aq) + S²⁻(aq)
Ion sulfida adalah basa konjugasi dari asam lemah HS⁻. Oleh karena itu, ion S²⁻ bereaksi dengan ion H⁺ sebagai berikut:
S²⁻(aq) + H⁺(aq) → HS⁻(aq)
Reaksi ini menghilangkan ion S²⁻ dari larutan. Menurut prinsip Le Châtelier, kesetimbangan akan bergeser ke kanan untuk menggantikan beberapa ion S²⁻ yang dihilangkan, sehingga meningkatkan kelarutan CuS.
(b) Ekuilibrium kelarutan adalah
AgCl(s) ⇋ Ag⁺(aq) + Cl⁼(aq)
Karena Cl⁻ adalah basa konjugasi dari asam kuat (HCl), kelarutan AgCl tidak dipengaruhi oleh larutan asam.
(c) Ekuilibrium kelarutan untuk PbSO₄ adalah
PbSO₄(s) ⇋ Pb²⁺(aq) + SO₄²⁻(aq)
Ion sulfat adalah basa lemah karena merupakan basa konjugasi dari asam lemah HSO₄⁻. Oleh karena itu, ion SO₄²⁻ bereaksi dengan ion H⁺ sebagai berikut:
SO₄²⁻(aq) + H⁺(aq) → HSO₄⁻(aq)
Reaksi ini menghilangkan ion SO₄²⁻ dari larutan. Menurut prinsip Le Châtelier, kesetimbangan akan bergeser ke kanan untuk menggantikan sebagian ion SO₄²⁻ yang dihilangkan, sehingga meningkatkan kelarutan PbSO₄.
Hitung konsentrasi amonia encer yang diperlukan untuk memulai pengendapan besi (II) hidroksida dari larutan 0,0030 M FeCl₂.
Strategi
Agar besi (II) hidroksida mengendap dari larutan, produk [Fe²⁺] [OH⁻]² harus lebih besar dari Ksp-nya. Pertama, perlu dihitung [OH⁻] dari [Fe²⁺] yang diketahui dan nilai Ksp yang tercantum dalam Tabel 16.2. Ini adalah konsentrasi OH⁻ dalam larutan jenuh Fe(OH)₂. Selanjutnya, perlu dihitung konsentrasi NH₃ yang akan mensuplai konsentrasi ion OH⁻ ini. Akhirnya, konsentrasi NH₃ yang lebih besar dari nilai yang dihitung akan memulai pengendapan Fe(OH)₂ karena larutan akan menjadi jenuh.
Penyelesaian
Amonia bereaksi dengan air menghasilkan ion OH⁻, yang kemudian bereaksi dengan Fe²⁺ membentuk Fe(OH)₂. Kesetimbangannya adalah
NH₃(aq) + H₂O(l) ⇋ NH₄⁺(aq) + OH⁻(aq)
Fe²⁺(aq) + 2OH⁻(aq) ⇋ Fe(OH)₂(s)
Pertama-tama ditemukan konsentrasi OH⁻ yang di atasnya Fe(OH)₂ mulai mengendap. Dapat ditulis
Ksp = [Fe²⁺][OH⁻]²=1,6 X 10⁻¹⁴
Karena FeCl₂ adalah elektrolit kuat, [Fe²⁺] = 0,0030 M dan
Selanjutnya dihitung konsentrasi NH₃ yang akan mensuplai 2,3 X 10⁻⁶ M ion OH⁻. Misalkan x adalah konsentrasi awal NH₃ dalam mol/L. Dapat dirangkum perubahan konsentrasi yang dihasilkan dari ionisasi NH₃ sebagai berikut.
Mengganti konsentrasi kesetimbangan dalam ekspresi konstanta ionisasi (lihat Tabel 15.4),
Memecahkan x, didapatkan x:
x = 2,6 x 10⁻⁶ M
Oleh karena itu, konsentrasi NH₃ harus sedikit lebih besar dari 2,6 x 10⁻⁶ M untuk memulai pengendapan Fe(OH)₂.
3. Contoh 16.15
Sebanyak 0,20 mol CuSO₄ ditambahkan ke satu liter larutan 1,20 M NH₃. Berapa konsentrasi ion Cu²⁺ pada kesetimbangan?
Strategi
Penambahan CuSO₄ ke dalam larutan NH₃ menghasilkan pembentukan ion kompleks
Cu²⁺(aq) + 4NH₃(aq) ⇋ Cu(NH₃)₄²⁺(aq)
Jumlah NH₃ yang dikonsumsi dalam pembentukan ion kompleks adalah 4 x 0,20 mol, atau 0,80 mol. (Perhatikan bahwa 0,20 mol Cu²⁺ awalnya hadir dalam larutan dan empat molekul NH₃ diperlukan untuk membentuk ion kompleks dengan satu ion Cu²⁺.) Oleh karena itu, konsentrasi NH₃ pada kesetimbangan adalah (1,20 - 0,80) mol/L larutan atau 0,40 M, dan bahwa Cu(NH₃)₄²⁺ adalah 0,20 mol/L larutan atau 0,20 M, sama dengan konsentrasi awal Cu²⁺. [Ada perbandingan mol 1: 1 antara Cu²⁺ dan Cu(NH₃)₄²⁺.] Karena Cu(NH₃)₄²⁺ tidak terdisosiasi sedikit, disebut konsentrasi Cu²⁺ pada kesetimbangan x dan tuliskan
5 x 10¹³=0,2/x(0,4)⁴
Dengan menyelesaikan x dan mengingat bahwa volume larutan adalah 1 L, didapatkan
x = [Cu²⁺]=1,6 x 10¹³M
Kuis 5 :
1. Larutan jenuh basa L(OH)3 mempunyai pH = 10. Nilai Ksp basa itu adalah . . . .
a. 3,3 x 10-17
b. 4 x 10-16
c. 2,7 x 10-15
d. 4 x 10-12
e. 3,3 x 10-5
Jawaban : C
Pembahasan:
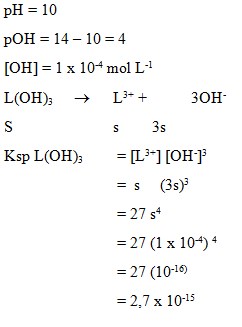
2. Rumus hasil kali kelarutan (KSP) Ag2CrO4 dinyatakan sebagai…
a. [Ag] [CrO4]
b. [Ag+] [CrO4-2]
c. [Ag+]2 [CrO4-2]
d. [Ag+] [CrO–]4
e. [Ag4+]2 [CrO2]4
Pembahasan:
![]()
Jawaban : C
3. Jika kelarutan Ca(OH)2 dalam air adalah s mol L-1, maka hasil kali kelarutan Ca(OH)2..
a. s2
b. s3
c. 2s3
d. 4s3
e. 16s4
Pembahasan
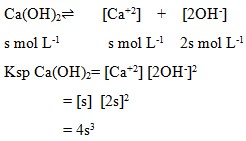





Tidak ada komentar:
Posting Komentar